Główny Inspektorat Farmaceutyczny (GIF) wycofał z obrotu 17 serii popularnego leku na kaszel Pulmopect. Decyzja ta została podjęta po wykryciu poważnych wad jakościowych w produkcie. Wada polegała na występowaniu galaretowatej substancji w syropie, która nie rozpuszczała się mimo wstrząsania butelką. Podmiot odpowiedzialny, Adamed Pharma S.A., poinformował, iż problem dotyczy zarówno opakowań 200 ml, jak i 100 ml.

Fot. Shutterstock / Warszawa w Pigułce
Co to za lek?
Pulmopect to syrop przeciwkaszlowy zawierający lewodropropizynę, substancję aktywną o działaniu obwodowym na oskrzela. Lek stosowany jest w terapii suchego, nieproduktywnego kaszlu, zarówno u dzieci powyżej 2. roku życia, jak i dorosłych. Oprócz działania przeciwkaszlowego, syrop wykazuje adekwatności przeciwhistaminowe i łagodzące skurcze oskrzeli wywołane przez histaminę, serotoninę czy bradykininę.
Dlaczego wycofano Pulmopect?
Decyzja o wycofaniu leku z rynku zapadła po zgłoszeniu przez producenta wady jakościowej. Kluczowym problemem była niejednorodna konsystencja roztworu i obecność galaretowatej substancji, która nie powinna występować w prawidłowo wyprodukowanym syropie. Wada została potwierdzona w kilku seriach leku, co skłoniło GIF do rozszerzenia wycofania na kolejne partie.
Wycofanie poprzedziło wstrzymanie w obrocie trzech serii, w tym numerów 24371007A, 23371022C i 23371024A, co wskazuje na szerszy problem produkcyjny. Decyzja obejmuje również zakaz dalszego wprowadzania do obrotu wszystkich wycofanych serii na terenie kraju.
Skala problemu
Według danych z serwisu KtoMaLek.pl, w ciągu ostatnich 30 dni sprzedano ponad 16 tysięcy opakowań wadliwych partii Pulmopect. Najwięcej sprzedano w Warszawie, gdzie pacjenci wykupili ponad 550 opakowań. Wysoką sprzedaż odnotowano także w aptekach w Szczecinie i Gdańsku.
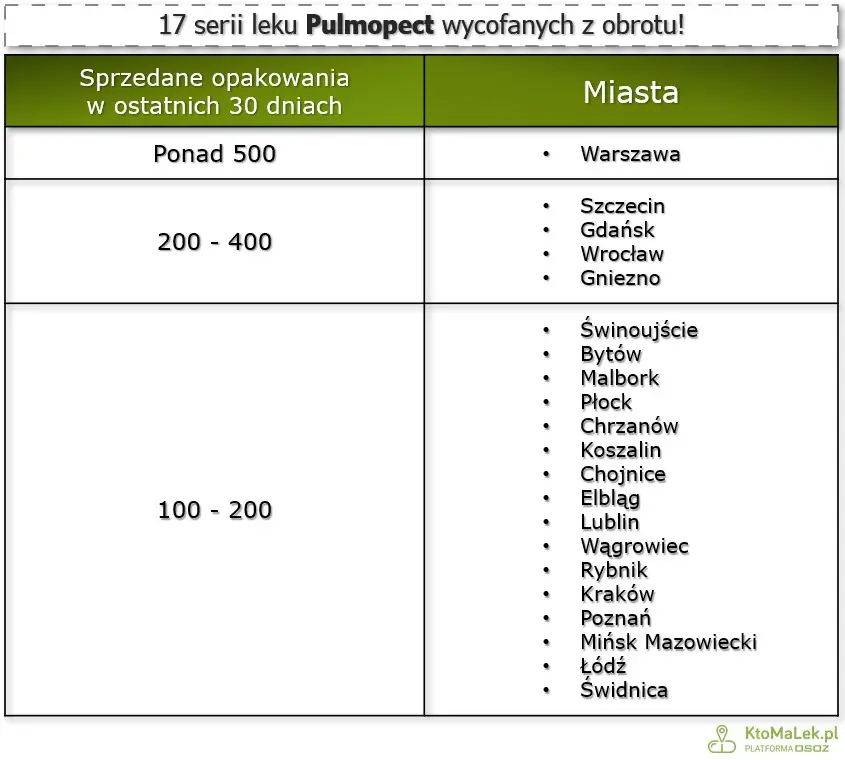
Fot. KtoMaLek
Lista wycofanych serii
Zgodnie z decyzją GIF, wycofane zostały następujące serie syropu Pulmopect:
- Pulmopect 30 mg/5 ml, 200 ml: 23371001A, 23371002A, 23371003A, 23371004A, 23371013A, 23371014A, 23371015A, 23371016A, 23371017A, 23371018A, 23371022C, 23371023A, 23371024A, 24371007A, 24371008A, 24371009A.
- Pulmopect 30 mg/5 ml, 100 ml: 23371022A.
Każda z wycofanych serii ma datę ważności od marca 2025 do stycznia 2026 roku.
Co zrobić, jeżeli masz wadliwy lek?
Pacjenci, którzy posiadają opakowania wycofanych serii, powinni niezwłocznie zaprzestać ich stosowania i zwrócić produkt do apteki. Farmaceuci są zobowiązani do przyjmowania takich leków i informowania pacjentów o dalszych krokach. W przypadku pojawienia się niepokojących objawów po przyjęciu leku należy skonsultować się z lekarzem.
Bezpieczeństwo pacjentów priorytetem
Główny Inspektorat Farmaceutyczny podkreśla, iż decyzje o wycofaniu leków są podejmowane wyłącznie w sytuacjach, gdy istnieje zagrożenie dla zdrowia pacjentów. W przypadku Pulmopect, choć wada dotyczyła głównie konsystencji syropu, to jej obecność mogła wpłynąć na skuteczność i bezpieczeństwo stosowania leku.
Pulmopect a działania producenta
Adamed Pharma S.A., jako podmiot odpowiedzialny za produkcję Pulmopectu, współpracuje z GIF w celu rozwiązania problemu. Producent zobowiązał się do przeprowadzenia dodatkowych kontroli jakości w celu zapobiegania podobnym sytuacjom w przyszłości. Firma deklaruje, iż bezpieczeństwo pacjentów pozostaje jej najwyższym priorytetem.
Wycofanie Pulmopectu to przypomnienie o konieczności szczególnej uwagi podczas zakupu i stosowania leków. Pacjenci powinni regularnie sprawdzać komunikaty GIF, aby upewnić się, iż produkty, które stosują, są w pełni bezpieczne.

 3 godzin temu
3 godzin temu